- Pengarang Alex Aldridge [email protected].
- Public 2023-12-17 13:46.
- Diubah suai terakhir 2025-06-01 07:37.
Perbezaan utama antara asid karbonik dan bikarbonat ialah asid karbonik ialah sebatian kimia neutral, manakala bikarbonat ialah sebatian kimia bercas negatif.
Asid karbonik ialah asid lemah yang terbentuk dalam larutan apabila karbon dioksida larut dalam air, dengan formula kimia H2CO3. Bikarbonat terbentuk melalui gabungan tiga atom oksigen, atom hidrogen dan atom karbon dengan formula kimia HCO3-.
Apakah Asid Karbonik?
Asid karbonik ialah H2CO3. Kadangkala, kami memberikan nama ini kepada larutan yang mempunyai karbon dioksida terlarut dalam air atau air berkarbonat. Ini kerana air berkarbonat mengandungi sejumlah kecil H2CO3. Tambahan pula, asid karbonik adalah asid lemah, dan ia boleh membentuk dua jenis garam sebagai karbonat dan bikarbonat. Jisim molar sebatian ini ialah 62.024 g/mol.
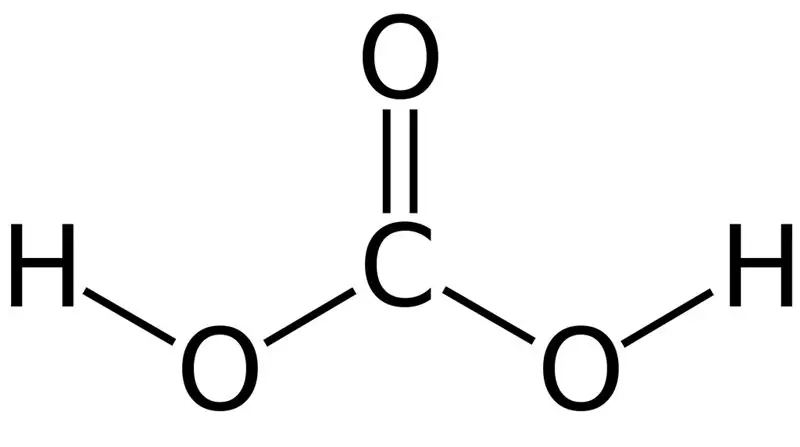
Rajah 01: Struktur Kimia Asid Karbonik
Apabila karbon dioksida larut dalam air, ia memasuki keseimbangan antara karbon dioksida dan asid karbonik. Keseimbangan adalah seperti berikut:
CO2 + H2O ⟷ H2CO3
Jika kita menambah lebihan asid karbonik ke dalam bes, ia memberikan bikarbonat. Tetapi, jika terdapat lebihan asas, maka asid karbonik cenderung untuk memberikan garam berkarbonat. Lebih tepat lagi, asid karbonik ialah sebatian asid karboksilik yang mempunyai dua substituen kumpulan hidroksil yang melekat pada karbon karbonil. Selain itu, ia adalah asid poliprotik, yang mampu menderma proton. Ia mempunyai dua proton boleh tanggal, jadi ia secara khusus diprotik.
Apakah itu Bikarbonat?
Bikarbonat terbentuk melalui gabungan tiga atom oksigen, atom hidrogen dan atom karbon. Hasil daripada gabungan ini boleh menjadi ion atau sebatian dengan lebih banyak elektron daripada proton. Kita boleh menggambarkannya sebagai spesies kimia yang mempunyai formula kimia HCO3-.
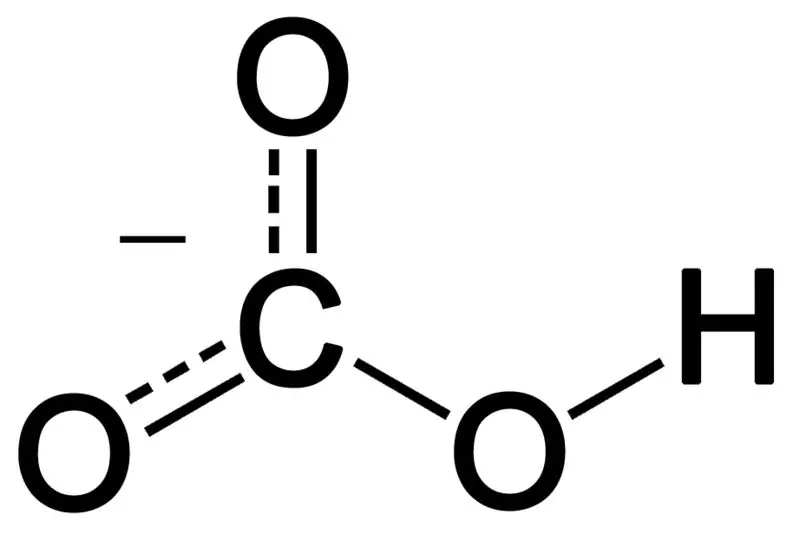
Rajah 02: Struktur Kimia Anion Bikarbonat
Kompaun ini merupakan bahagian penting dalam sistem penimbalan pH badan, dari segi orang biasa: ia bertanggungjawab untuk mengekalkan darah seseorang dalam keadaan tidak terlalu berasid atau terlalu asas. Di samping itu, ia berfungsi sebagai cara untuk memastikan jus pencernaan terkawal sebaik sahaja perut selesai mencerna makanan. Tambahan pula, asid karbonik dalam air hujan membentuk ion bikarbonat apabila terkena batu. Aliran ion bikarbonat ini penting dalam mengekalkan kitaran karbon.
Apakah Perbezaan Antara Asid Karbonik dan Bikarbonat?
Asid karbonik ialah asid lemah yang terbentuk dalam larutan apabila karbon dioksida larut dalam air, dan formula kimianya ialah H2CO3. Bikarbonat terbentuk dengan gabungan tiga atom oksigen, atom hidrogen, dan atom karbon dengan formula kimia HCO3-. Perbezaan utama antara asid karbonik dan bikarbonat ialah asid karbonik ialah sebatian kimia neutral, manakala bikarbonat ialah sebatian kimia bercas negatif. Selain itu, asid karbonik digunakan dalam membuat minuman berbuih, bergas, merawat dermatitid, dalam ubat kumur, dsb., manakala bikarbonat digunakan dalam penyediaan makanan seperti penaik (sebagai agen penaik), dan ia memberikan keupayaan untuk menahan perubahan pH.
Infografik berikut meringkaskan perbezaan antara asid karbonik dan bikarbonat dalam bentuk jadual untuk perbandingan sebelah menyebelah.
Ringkasan - Asid Karbonik lwn Bikarbonat
Asid karbonik ialah H2CO3. Bikarbonat terbentuk dengan gabungan tiga atom oksigen, atom hidrogen dan atom karbon, dengan formula kimia HCO3-. Perbezaan utama antara asid karbonik dan bikarbonat ialah asid karbonik ialah sebatian kimia neutral, manakala bikarbonat ialah sebatian kimia bercas negatif.






