- Pengarang Alex Aldridge [email protected].
- Public 2023-12-17 13:46.
- Diubah suai terakhir 2025-06-01 07:37.
Perbezaan Utama - Ligan Kuat vs Ligan Lemah
Ligand ialah atom, ion atau molekul yang menderma atau berkongsi dua elektronnya melalui ikatan kovalen koordinat dengan atom atau ion pusat. Konsep ligan dibincangkan di bawah kimia koordinasi. Ligan adalah spesies kimia yang terlibat dalam pembentukan kompleks dengan ion logam. Oleh itu, mereka juga dikenali sebagai agen pengkompleks. Ligan boleh menjadi Monodentate, bidentate, tridentate, dll. berdasarkan ketumpatan ligan. Dentikiti ialah bilangan kumpulan penderma yang terdapat dalam ligan. Monodentate bermaksud ligan hanya mempunyai satu kumpulan penderma. Bidentate bermakna ia mempunyai dua kumpulan penderma bagi setiap satu molekul ligan. Terdapat dua jenis ligan utama yang dikategorikan berdasarkan teori medan kristal; ligan kuat (atau ligan medan kuat) dan ligan lemah (atau ligan medan lemah). Perbezaan utama antara ligan kuat dan ligan lemah ialah pemisahan orbital selepas mengikat ligan medan kuat menyebabkan perbezaan yang lebih tinggi antara orbital tahap tenaga yang lebih tinggi dan lebih rendah manakala pemisahan orbital selepas mengikat ligan medan yang lemah menyebabkan perbezaan yang lebih rendah. antara orbital aras tenaga yang lebih tinggi dan lebih rendah.
Apakah Teori Medan Kristal?
Teori medan kristal boleh dihuraikan sebagai model yang direka untuk menerangkan pemecahan degenerasi (kulit elektron dengan tenaga yang sama) orbital elektron (biasanya orbital d atau f) disebabkan oleh medan elektrik statik yang dihasilkan oleh persekitaran. anion atau anion (atau ligan). Teori ini sering digunakan untuk menunjukkan kelakuan kompleks ion logam peralihan. Teori ini boleh menerangkan sifat magnet, warna kompleks koordinasi, entalpi penghidratan, dll.
Teori:
Interaksi antara ion logam dan ligan adalah hasil daripada tarikan antara ion logam dengan cas positif dan cas negatif bagi elektron tidak berpasangan ligan. Teori ini terutamanya berdasarkan perubahan yang berlaku dalam lima orbital elektron terdegenerasi (atom logam mempunyai lima orbital d). Apabila ligan mendekati ion logam, elektron yang tidak berpasangan lebih dekat dengan beberapa orbital d daripada orbital d ion logam yang lain. Ini menyebabkan kehilangan degenerasi. Dan juga, elektron dalam orbital d menolak elektron ligan (kerana kedua-duanya bercas negatif). Oleh itu orbital d yang lebih dekat dengan ligan mempunyai tenaga yang tinggi berbanding orbital d yang lain. Ini mengakibatkan pemisahan orbital d kepada orbital d tenaga tinggi dan orbital d tenaga rendah, berdasarkan tenaga.
Beberapa faktor yang mempengaruhi pemisahan ini ialah; sifat ion logam, keadaan pengoksidaan ion logam, susunan ligan di sekeliling ion logam pusat dan sifat ligan. Selepas pemisahan orbital d ini berdasarkan tenaga, perbezaan antara orbital d tenaga tinggi dan rendah dikenali sebagai parameter pemisahan medan kristal (∆okt untuk kompleks oktahedral).
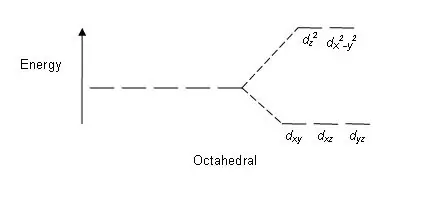
Rajah 01: Corak Pemisahan dalam Kompleks Oktahedral
Corak pemisahan: Oleh kerana terdapat lima orbital d, pemisahan berlaku dalam nisbah 2:3. Dalam kompleks oktahedral, dua orbital berada dalam tahap tenaga tinggi (secara kolektif dikenali sebagai 'cth'), dan tiga orbital berada dalam tahap tenaga yang lebih rendah (secara kolektif dikenali sebagai t2g). Dalam kompleks tetrahedral, sebaliknya berlaku; tiga orbital berada dalam tahap tenaga yang lebih tinggi dan dua dalam tahap tenaga yang lebih rendah.
Apakah Ligand Kuat?
Ligand kuat atau ligan medan kuat ialah ligan yang boleh mengakibatkan pembelahan medan kristal yang lebih tinggi. Ini bermakna, pengikatan ligan medan yang kuat menyebabkan perbezaan yang lebih tinggi antara orbital aras tenaga yang lebih tinggi dan lebih rendah. Contohnya termasuk CN- (ligan sianida), NO2- (ligan nitro) dan CO (karbonil ligan).
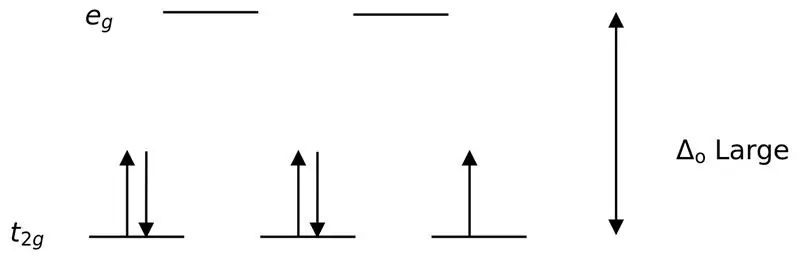
Rajah 02: Pemisahan Putaran Rendah
Dalam pembentukan kompleks dengan ligan ini, pada mulanya, orbital tenaga yang lebih rendah (t2g) diisi sepenuhnya dengan elektron sebelum mengisi ke mana-mana orbital tahap tenaga tinggi yang lain (cth). Kompleks yang terbentuk dengan cara ini dipanggil "kompleks putaran rendah".
Apakah Ligand Lemah?
Ligand lemah atau ligan medan lemah ialah ligan yang boleh mengakibatkan pembelahan medan kristal yang lebih rendah. Ini bermakna, pengikatan ligan medan yang lemah menyebabkan perbezaan yang lebih rendah antara orbital aras tenaga yang lebih tinggi dan lebih rendah.
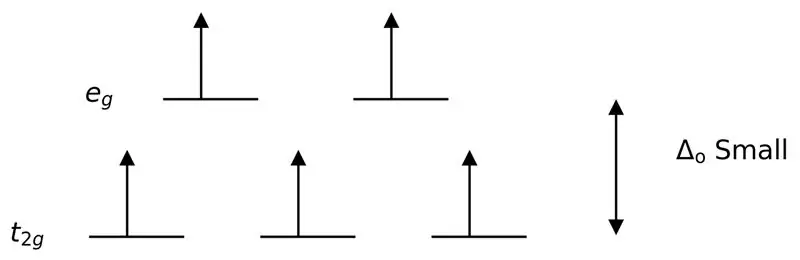
Rajah 3: Pemisahan Putaran Tinggi
Dalam kes ini, memandangkan perbezaan yang rendah antara dua tahap orbit menyebabkan tolakan antara elektron dalam tahap tenaga tersebut, orbital tenaga yang lebih tinggi boleh diisi dengan mudah dengan elektron jika dibandingkan dengan orbital tenaga rendah. Kompleks yang terbentuk dengan ligan ini dipanggil "kompleks putaran tinggi". Contoh ligan medan lemah termasuk I- (ligan iodida), Br- (ligan bromida), dsb.
Apakah Perbezaan Antara Ligan Kuat dan Ligan Lemah?
Ligand Kuat lwn Ligan Lemah |
|
| Ligand kuat atau ligan medan kuat ialah ligan yang boleh mengakibatkan pembelahan medan kristal yang lebih tinggi. | Ligand lemah atau ligan medan lemah ialah ligan yang boleh mengakibatkan pembelahan medan kristal yang lebih rendah. |
| Teori | |
| Pecahan selepas mengikat ligan medan yang kuat menyebabkan perbezaan yang lebih tinggi antara orbital aras tenaga yang lebih tinggi dan lebih rendah. | Pemecahan orbital selepas mengikat ligan medan yang lemah menyebabkan perbezaan yang lebih rendah antara orbital tahap tenaga yang lebih tinggi dan lebih rendah. |
| Kategori | |
| Kompleks yang terbentuk dengan ligan medan yang kuat dipanggil “kompleks putaran rendah”. | Kompleks yang terbentuk dengan ligan medan lemah dipanggil “kompleks putaran tinggi”. |
Ringkasan - Ligan Kuat lwn Ligan Lemah
Ligand kuat dan ligan lemah ialah anion atau molekul yang menyebabkan pemisahan orbital d ion logam kepada dua tahap tenaga. Perbezaan antara ligan kuat dan ligan lemah ialah pembelahan selepas mengikat ligan medan kuat menyebabkan perbezaan yang lebih tinggi antara orbital tahap tenaga yang lebih tinggi dan lebih rendah manakala pemisahan orbital selepas mengikat ligan medan yang lemah menyebabkan perbezaan yang lebih rendah antara yang lebih tinggi dan lebih rendah. orbital aras tenaga.






