- Pengarang Alex Aldridge [email protected].
- Public 2023-12-17 13:46.
- Diubah suai terakhir 2025-06-01 07:37.
Perbezaan utama antara tindak balas tertib pertama dan kedua ialah kadar tindak balas tertib pertama bergantung pada kuasa pertama kepekatan bahan tindak balas dalam persamaan kadar manakala kadar tindak balas tertib kedua bergantung pada kuasa kedua kepekatan istilah dalam persamaan kadar.
Tertib tindak balas ialah jumlah kuasa yang mana kepekatan bahan tindak balas dinaikkan dalam persamaan hukum kadar. Terdapat beberapa bentuk tindak balas mengikut definisi ini; tindak balas tertib sifar (tindak balas ini tidak bergantung kepada kepekatan bahan tindak balas), tindak balas tertib pertama dan tindak balas tertib kedua.
Apakah Reaksi Tertib Pertama?
Tindak balas tertib pertama ialah tindak balas kimia yang kadar tindak balasnya bergantung kepada kepekatan molar salah satu bahan tindak balas yang terlibat dalam tindak balas. Oleh itu, mengikut takrifan di atas untuk susunan tindak balas, jumlah kuasa yang mana kepekatan bahan tindak balas dinaikkan dalam persamaan hukum kadar akan sentiasa 1. Mungkin terdapat sama ada satu bahan tindak balas yang mengambil bahagian dalam tindak balas ini. Kemudian kepekatan bahan tindak balas itu menentukan kadar tindak balas. Tetapi kadangkala, terdapat lebih daripada satu bahan tindak balas yang mengambil bahagian dalam tindak balas ini, maka salah satu daripada bahan tindak balas ini akan menentukan kadar tindak balas.
Mari kita pertimbangkan satu contoh untuk memahami konsep ini. Dalam tindak balas penguraian N2O5, ia membentuk NO2 dan O 2 gas sebagai produk. Oleh kerana ia hanya mempunyai satu bahan tindak balas, kita boleh menulis tindak balas dan persamaan kadar seperti berikut.
2N2O5(g) → 4NO2(g) + O 2(g)
Kadar=k[N2O5(g)]m
Di sini k ialah pemalar kadar bagi tindak balas ini dan m ialah susunan tindak balas. Oleh itu, daripada penentuan eksperimen, nilai m ialah 1. Oleh itu, ini ialah tindak balas tertib pertama.
Apakah Reaksi Tertib Kedua?
Tindak balas tertib kedua ialah tindak balas kimia yang kadar tindak balasnya bergantung pada kepekatan molar dua bahan tindak balas atau kuasa kedua satu bahan tindak balas yang terlibat dalam tindak balas. Oleh itu, mengikut takrifan di atas untuk susunan tindak balas, jumlah kuasa yang mana kepekatan bahan tindak balas dinaikkan dalam persamaan hukum kadar akan sentiasa 2. Jika terdapat dua bahan tindak balas, kadar tindak balas akan bergantung kepada kuasa pertama daripada kepekatan setiap bahan tindak balas.
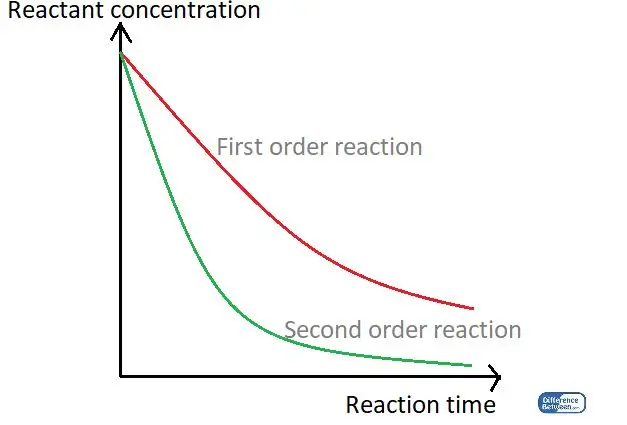
Rajah 01: Graf yang membandingkan dua jenis susunan tindak balas menggunakan masa tindak balasnya dan kepekatan bahan tindak balas.
Jika kita meningkatkan kepekatan bahan tindak balas sebanyak 2 kali (jika terdapat dua bahan tindak balas dalam persamaan kadar), maka kadar tindak balas meningkat sebanyak 4 kali ganda. Sebagai contoh, mari kita pertimbangkan tindak balas berikut.
2A → P
Di sini A ialah bahan tindak balas dan P ialah hasil darab. Kemudian jika ini adalah tindak balas tertib kedua, persamaan kadar untuk tindak balas ini adalah seperti berikut.
Kadar=k[A]2
Tetapi untuk tindak balas dengan dua bahan tindak balas yang berbeza seperti berikut;
A + B → P
Kadar=k[A]1[B]1
Apakah Perbezaan Antara Reaksi Tertib Pertama dan Kedua?
Tindak balas tertib pertama ialah tindak balas kimia yang kadar tindak balasnya bergantung kepada kepekatan molar salah satu bahan tindak balas yang terlibat dalam tindak balas. Oleh itu, jika kita meningkatkan kepekatan bahan tindak balas sebanyak 2 kali, kadar tindak balas meningkat sebanyak 2 kali. Tindak balas tertib kedua ialah tindak balas kimia yang kadar tindak balasnya bergantung kepada kepekatan molar dua bahan tindak balas atau kuasa kedua satu bahan tindak balas yang terlibat dalam tindak balas. Oleh itu, jika kita meningkatkan kepekatan bahan tindak balas sebanyak 2 kali, kadar tindak balas meningkat sebanyak 4 kali. Maklumat grafik di bawah menunjukkan perbezaan antara tindak balas tertib pertama dan kedua dalam bentuk jadual.

Ringkasan - Reaksi Tertib Pertama vs Kedua
Terdapat tiga jenis tindak balas utama mengikut susunan tindak balas; tertib sifar, tertib pertama dan tindak balas tertib kedua. Perbezaan utama antara tindak balas tertib pertama dan kedua ialah kadar tindak balas tertib pertama bergantung kepada kuasa pertama kepekatan bahan tindak balas dalam persamaan kadar manakala kadar tindak balas tertib kedua bergantung pada kuasa kedua jangka kepekatan dalam persamaan kadar.






